 Δημοσιεύτηκε από το χρήστη Αντώνης Μπαλτζόπουλος στις 31 Μάιος 2013 στις 0:00 στην ομάδα Χημεία Γ΄Λυκείου
Δημοσιεύτηκε από το χρήστη Αντώνης Μπαλτζόπουλος στις 31 Μάιος 2013 στις 0:00 στην ομάδα Χημεία Γ΄Λυκείου
Ένα υδατικό δίάλυμα περιέχει HCL και CH3COOH σε άγνωστες συγκεντρώσεις .
Λαμβάνουμε 10 mL από το διάλυμα αυτό και το ογκομετρούμε με πρότυπο διάλυμα NaOH 0.1 M
Οι μετρήσεις των τιμών pH που πήραμε ήταν οι παρακάτω :
( 1η στήλη : mL του προτύπου που προσθέσαμε
2η στήλη : pH του διαλύματος που προκύπτει )
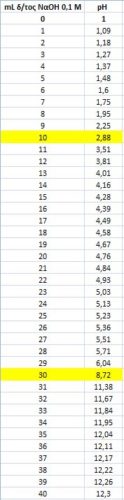
Με την βοήθεια υπολογιστικού προγράμματος κατασκευάσαμε την καμπύλη τιτλοδότησης του διαλύματος
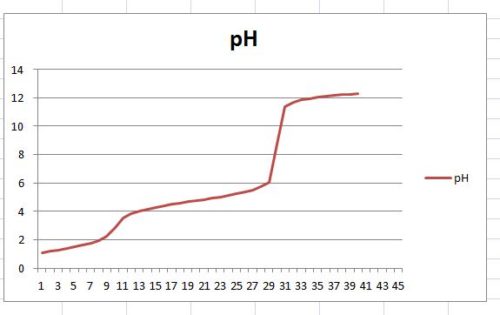
από την οποία θεωρήσαμε ώς ισοδύναμα σημεία στους όγκους 10 mL και 30mL
Να βρεθούν οι συγκεντρώσεις των οξέων στο διάλυμα .
Ολα τα διαλύματα είναι υδατικά στους 25οC
Δίνονται : Kw = 10^-14
K(CH3COOH) = 1.7504*10^-5
Η χρήση αριθμομηχανών επιβάλλεται
υγ #1 …. τα επιπλέον δεδομένα είναι ευγενική χορηγία του Yridium
υγ #2….. όλα τα δεδομένα δεν είναι καθόλου τυχαία .
![]()
…. για να μην παρεξηγηθώ …. ΠΡΟΦΑΝΩΣ δεν βάζω άσκηση.
Απλώς παραθέτω ένα πείραμα ( μεσω Yridium ) ώστε να δούμε πώς θα μπορούσαμε να εφαρμόσουμε όλες τις απόψεις πάνω σε πραγματικές συνθήκες .
Οι συγκεντρώσεις είναι 0,1Μ και 0,3Μ ….
Μήπως οι συγκεντρώσεις είναι… HCl 0,1 Μ και CH3COOH 0,2 Μ; Επειδή χρειάζονται 30 ml διαλύματος ΝαΟΗ 0,1 M για την πλήρη εξουδετέρωση και των 2 οξέων, άρα έχουμε 3 mmol οξέων συνολικά…
(Δεν παίρνω και όρκο βέβαια γιατί η ώρα είναι περασμένη και την έχω ξαναπατήσει με υπολογισμούς νυχτιάτικα…)
Συγχαρητήρια για την ανάρτηση! Ογκομέτρηση μίγματος ισχυρού και ασθενούς οξέος… Είναι όμορφο να θυμάται κανείς πράγματα που έχει πολύ καιρό να δει ή και έχει ξεχάσει. Η μορφή της καμπύλης είναι όμοια με την αντίστοιχη της ογκομέτρησης ενός διπρωτικού οξέος.
Κι εγώ νομίζω ότι βγαίνει HCl 0,1M και CH3COOH 0,2M…
Την Κα να φανταστώ τη δίνεις για επιβεβαίωση των αριθμητικών δεδομένων που δείχνει το πείραμα.
Και φυσικά η απάντηση (?) στο τεράστιο ερώτημα των ημερών: Εξουδετερώθηκε πρώτα το HCl…
…. 0,1Μ – 0,2Μ ….. ( τελικά είναι κανείς που διαβάζει-λύνει την ημέρα ? )
( δεν μπορώ να κάνω edit στο 2ο ποστ μου …. ελπίζω να μην μπερδέψω κανέναν )
Την σταθερά την δίνω γιατί την έχω ( έχω υπολογίσει τις περισσότερες σταθερές του Yridium για να ελέγχω και πειραματικά κάποιες ασκήσεις ) ….. είναι αυτό το επιπλέον δεδομένο που λέω
Τεστάρω με μερικούς συναδέλφους μια άσκηση που θα δημοσιεύσω ( στο blog μου στο ylikonet ) χωρίς αυτά τα παραπανήσια δεδομένα ( ώστε να στρώσει σαν άσκηση )
Το μεσημέρι θα δοκιμάσω και το σενάριο 0,2 mol ισχυρού – 0,1 mol ασθενούς για να δούμε έαν το ισχυρό “εμφανίζεται” να εξουδετερώνεται 1ο λόγω των λιγότερων mol που έχει …
Εν αναμονή ….
Συνάδελφοι ανεξάρτητα από τις σχετικές ποσότητες ασθενούς και ισχυρού οξέος, η προστιθέμενη ποσότητα της ισχυρής βάσης (τα υδροξείδιά της) θα εξουδετερώσει αρχικά όση ποσότητα έχει προκύψει από τη διάσταση του ισχυρού (όχι τα ίδια οξώνια που προέκυψαν από τη διάστασή του, αλλά ίση ποσότητα). Στη συνέχεια, αφού συνεχίζεται η προσθήκη, θα γίνει εξουδετέρωση των οξωνίων που παράγονται από τον ιοντισμό του ασθενούς έως ότου εξαντληθεί όλο η ποσότητα του ασθενούς (αφού η ισορροπία του θα μετατοπίζεται συνεχώς προς τα δεξιά, λόγω ελάττωσης των οξωνίων, ουσίας στο β΄μέλος της αμφίδρομης εξίσωσης)
Ογκομέτρηση διαλύματος HCL 0.2 M – CH3COOH 0.1 M με πρότυπο διάλυμα ΝαΟΗ 0,1 Μ
Τιμές pH κατά την τιτλοδότηση ( μέτρηση pH μέσω Irydium )
Κατασκευή καμπύλης τιτλοδότησης
Χρήση της 1η παραγώγου για να φανούν πιο ευδιάκριτα τα ισοδύναμα σημεία
Αυτό όμως που έχει πιο μεγάλο ενδιαφέρον είναι η σύγκριση των γραφικων παραστάσεων dpH / dV των δύο διαλυμάτων που έχουν περιγραφεί ( 0,1 -0,2 και 0,2 – 0,1 ).
Στην 1η περίπτωση έχει την μορφή :
Εκτός ότι φανερώνονται πάλι ( πιο έντονα ) τα ισοδύναμα σημεία των 10 και 30-10=20 ml ( για το 1ο διάλυμα …. HCl 0,1 Μ και CH3COOH 0,2 Μ) , σημαντική είναι η ΟΜΟΙΟΤΗΤΑ του ύψους των κορυφών
Υπεραπλουστεύοντας μερικές εκφράσεις θα έλεγα ότι όσο το διάλυμα “υπερασπίζεται” το pH του μέσα από την ιοντική ισορροπία του CH3COOH ( επίπέδου 10^-5 ) η μεταβολή του πε-χα του είναι μικρότερη από αυτή του CH3COO ( επιπέδου 10^-9 )
Ας δούμε την ακριβώς από πάνω γραφική ( θυμίζω διάλυμα HCL 0,1 Μ – CH3COOH 0,2 Μ )
Ποιος “αμύνεται” στην μεταβολή του pH του διαλύματος HCL-CH3COOH ?
Πρόσθεσα επίσης το ακόλουθο (Ποιο θα αντιδράσει πρώτα;)
Αντιμετωπίζω το πρόβλημα προσθέτοντας συνεχώς ποσότητα από την ισχυρή βάση.
Αρχικά, λόγω Ε.Κ.Ι., υπάρχουν (πρακτικά) μόνο οξώνια από τη διάσταση του ισχυρού. Ο ιοντισμός του ασθενούς, ως αμφίδρομη αντίδραση, είναι μετατοπισμένος προς τα αριστερά (λόγω της Ε.Κ.Ι.). Συνεπώς κάθε φορά θα αντιδρά (αν προσθέτουμε στάγδην την ποσότητα της ισχυρής βάσης) ίση (στοιχειομετρική, αλλά εδώ ίση) ποσότητα των οξωνίων με τα υδροξείδια της ισχυρής βάσης (που παράγονται από τη διάστασή της). Αυτό θα γίνεται μέχρι να αντιδράσει ίση ποσότητα των οξωνίων με αυτή που έχει παραχθεί από τη διάσταση του ισχυρού οξέος (ίση όχι ή ίδια). Στη συνέχεια θα αντιδράσουν (αν συνεχιστεί η προσθήκη της ισχυρής βάσης) οξώνια προερχόμενα από τον ιοντισμό του ασθενούς, μετατοπίζοντας την ισορροπία του προς τα δεξιά (αφού ελαττώνεται η συγκέντρωση των οξωνίων, ουσίας στο δεύτερο μέλος της αμφίδρομης αντίδρασης του ιονισμού). Παράγονται έτσι νέα οξώνια, τα οποία με τη σειρά τους θα δεσμευτούν από τα νέα υδροξείδια που παράγονται από τη διάσταση της νέας ποσότητας της ισχυρής βάσης που προστίθεται κ.ο.κ. μέχρι να εξαντληθεί όλη η ποσότητα του ασθενούς οξέος. Στη συνέχεια θα δεσμεύονται οξώνια από τον αυτοϊοντισμό του νερού (χωρίς βέβαια να εξαντληθούν ποτέ αυτά πλήρως).
Προφανώς αν προστεθεί ποσότητα της ισχυρής βάσης μικρότερη από την ποσότητα του ισχυρού οξέος, θα αντιδράσει ίση ποσότητα οξωνίων και θα έχουμε πάλι Ε.Κ.Ι. αλλά με ποσότητα των οξωνίων ίση με τη διαφορά της ποσότητας που προέκυψε από τη διάσταση του ισχυρού μείον (-) την ποσότητα των οξωνίων που δεσμεύτηκαν από τα υδροξείδια (που προέκυψαν από τη διάσταση τη βάσης που προστέθηκε).
Ρε συ Αντώνη,
η σύγκριση των γραφικων παραστάσεων dpH / dV των δύο διαλυμάτων
όπως την παρουσίασες είναι απλά ΕΚΠΛΗΚΤΙΚΗ!!!!
Permalink Απάντηση από τον/την Βιβή Γεωργίου στις 2 Ιούνιος 2013 στις 10:11
(Ζήλεψα κι εγώ κι άρχισα να δοκιμάζω διάφορα)
Καμπύλες ογκομέτρησης μίγματος 2 ασθενών οξέων
1) δ/τος HF 0,06 M – CH3COOH 0,12 M με ΝaOH 0,1 M (κόκκινη)
2) δ/τος CCl2HCOOH 0,05 M – CH3COOH 0,10 M με ΝaOH 0,1 M (μπλε)
3) δ/τος HCΝ 0,05 M – CH3COOH 0,10 M με ΝaOH 0,1 M (πράσινη)
Σταθερές ιοντισμού Ka : HF = 6,6 10-4, CCl2HCOOH = 5 10-2 , CH3COOH = 1,75 10-5, HCN = 6,02 10-10
Permalink Απάντηση από τον/την Αντώνης Χρονάκης στις 2 Ιούνιος 2013 στις 13:15
Vivi
Δείξε μας σε παρακαλώ, τις αντίστοιχες
γραφικές παραστάσεις dpH / dV για τον καλύτερο εντοπισμό
των ισοδύναμων σημείων.
Θα χρησιμεύσει ειδικά στη 1η περίπτωση (κόκκινη).
Φοβερη παρουσιαση Αντωνη!
Αν καταλαβαινω σωστα: στα 2 παραδειγματα ειναι οτι στο 1ο εχουμε
mol CH3COOH=2*mol HCL
και στο 2ο αντιθέτως mol HCl = 2* mol CH3COOH.
Στο 1ο βημα (με 10 ml και 20 ml δ.ΝαΟΗ αντιστοιχα) εξουδετερωνεται το ισχυρο οξύ. Με τα υπολοιπα (20ml-10 ml αντιστοιχα) εξουδετερωνεται το ασθενες οξύ.
Αλλά τελικά καταλήγουμε στο ιδιο ρΗ! (αυτο δεν θελεις να αναδειξεις?)
Να προσθεσω κατι γα το ποιος “αμυνεται”.
Πιστευω οτι το 11-29 ml μπορει να χωριστει σε 2 φάσεις. Απο 11-15 ml το Ρ.Δ εχει μεγαλη διαφορα σε Cοξ με Cβ άρα μικρη ρυθμιστικη ικανοτητα και εντονη μεταβολη του ρΗ. Απο 16-29 ml βελτιωνεται η ρυθμιστικη ικανοτητα.
Εκτιμώ ότι το dpH / dV είναι ενας εξαιρετικός τρόπος “παρακολούθησης” μια τιτλοδότησης και ταυτόχρονα τόσο άγνωστος προς εμένα ( φαντάζομαι και προς τους περισσότερους )
Να πώ πως η 2η παράγωγος δίνει ακόμα πιο ακριβή αποτελέσματα αλλά ακόμα είναι νωρίς – για μένα – να την προσεγγίσω.
Θέλω να δείξω …
Τα γράφω αυτά και με δόση πικρίας προς τους χαρακτηρισμούς που έδωσαν μερικοί συνάδελφοι προς τους μαθητές που “τολμησαν” να εξουδετερώσουν 1ο το ισχυρό ( τους είπαν μέτριους … τυχερούς … αδιάβαστους …. και βέβαια ο χαρακτηρισμός πάει και στον καθηγητή που τους το δίδαξε )
Είδαν το δέντρο και δεν είδαν το δάσος …. τέσπα ο καθένας συμμετέχει σε φόρουμ για να δώσει και να πάρει κάτι . Εγώ από την συζήτηση κέρδισα την γνώση ότι όποια αντίδραση και να βάλεις 1η , εάν εφαρμόσεις τις σωστές περίσσειες και εξαντλίσεις κάθε αντίδραση θα φτάσεις στο ίδιο αποτέλεσμα
( χωρίς βέβαια να σημαίνει ότι του χρόνου θα το διδάξω αλλιώς ….))
Αλλά σε παρακαλώ δεν θέλω να ξαναανοίξω αυτήν την συζήτηση σε αυτή το νήμα …
Η ρυθμιστική ικανότητα είναι κάτι που προέκυψε από την dpH / dV που όπως είπα και πριν είναι κάτι νέο – τουλάχιστον – σε μένα. Το αποτέλεσμα που λές είναι σωστό και να το διατυπώσω και εγώ λίγο αλλιώς ότι όσο πιο πολύ το ρυθμιστικό διάλυμα πλησιάζει στο 1:1 η ρυθμιστική ικανότητα αυξάνεται ( μικρότερες μεταβολές στο pH / mL προστιθέμενου προτύπου
… και βέβαια αυτή η μέγιστη άμυνα ( ρυθμιστική ικανότητα ) εμφανίζεται στο μέσο του τμήματος που “φωτογραφίζει” την ογκομέτρηση του ασθενούς …
Δες την τιμή pH που αντιστοιχεί στο μέσο της ογκομέτρησης που αφορά το CH3COOH ( δηλ στο 20 mL της 1η ογκομετρησης ή στο 25 mL της 2ης …. ) είναι 4,72 !!!!
Μάντεψε πόσο είναι η pKa του CH3COOH …..
( έλα ρε …δεν το πιστεύω … αυτό φωτογραφίζει ότι η εξουδετέρωση τους ασθενούς ώς 2η … αλλά είπαμε …όχι σε αυτό το νήμα )
Vivi
Δείξε μας σε παρακαλώ, τις αντίστοιχες
γραφικές παραστάσεις dpH / dV για τον καλύτερο εντοπισμό
των ισοδύναμων σημείων.
Θα χρησιμεύσει ειδικά στη 1η περίπτωση (κόκκινη).
Νόμιζα ότι είναι εμφανές, επειδή έδινα και τη σχέση των αρχικών συγκεντρώσεων.
(δεν έδωσα τον όγκο του διαλύματος που ογκομετρήθηκε, είναι 10 ml)
Διάλυμα 3ο: HCΝ 0,05 M – CH3COOH 0,10 M
1ο ΙΣ: VΙΣ = 10 ml , n1 = 10 ml*0,1 M = 1 mmol NaOH = 1 mmol CH3COOH
και 2ο ΙΣ V’ΙΣ = 15 ml – 10 ml = 5 ml , n2 = 5 ml*0,1 M = 0,5 mmol NaOH = 0,5 mmol HCN
Διάλυμα 2ο: CCl2HCOOH 0,05 M – CH3COOH 0,10 M
1ο ΙΣ: VΙΣ = 5 ml , n1 = 5 ml*0,1 M = 5 mmol NaOH = 5 mmol CCl2HCOOH
και 2ο ΙΣ V’ΙΣ = 15 ml – 5 ml = 10 ml , n2 = 10 ml*0,1 M = 1 mmol NaOH = 1 mmol CH3COOH
Διάλυμα 1ο: HF 0,06 M – CH3COOH 0,12 M
VΙΣ = 18 ml , n = 18 ml*0,1 M = 1,8 mmol NaOH = 1,8 mmol συνολικά οξέων.
Δεν μπορεί να γίνει διαχωρισμός γιατί τα οξέα είναι παραπλήσιας ισχύος (έχουν ίδιας τάξης Κα).
Συμπέρασμα: όταν η διαφορά ισχύος των δύο ασθενών οξέων είναι μεγάλη, τότε το ισχυρότερο οξύ καταναλώνεται πρώτο.
Όταν τα δύο ασθενή οξέα έχουν παραπλήσια ισχύ, η προσέγγιση (που έχει ξαναγραφτεί κάπου εδώ) του προσδιορισμου του pH μετά από μερική εξουδετέρωση με την παραδοχή της ύπαρξης δύο ρυθμιστικών ΗΑ-ΝaA , HB-NaB είναι ικανοποιητική. Σε άλλη περίπτωση θεωρούμε ότι καταναλώνεται πλήρως πρώτα το ισχυρότερο από τα δύο (λόγω της μετατόπισης της γνωστής ισορροπίας
ΗΑ + Β- <-> ΗΒ + Α-
πλήρως προς την πλευρά του ασθενέστερου μετά από κάθε προσθήκη ποσότητας βάσης).
Η γραφική παράσταση του ΔpH/ΔV συναρτήσει του V:
… και η γραφική παράσταση της δεύτερης παραγώγου του pH συναρτήσει του V:
Για να είμαι ειλικρινής, αρχικά είχα παρανοήσει την έκφραση «αντιδρά πρώτο» το ισχυρό οξύ. Εγω ισχυριζομουν ότι οι δυο αντιδράσεις εξουδετερωσης γινονται ταυτοχρονα, αφου τα οξωνια δεν φερουν «ταμπελακι» προελευσης. Εφοσον υπαρχουν οξώνια στο διαλυμα ειτε αυτα προερχονται απο το ισχυρο ειτε απο το ασθενες οξυ (ειτε ακομα και απο το νερο), μπορουν να αντιδρασουν αν τυχει και συγκρουσθουν με ενα ανιον ΟΗ- (πραγμα που αληθευει). Φυσικα λογω πιθανοτητων προχωρα πιο γρηγορα η αντιδραση με το ισχυρο.
Οταν αποκαθισταται η ισορροπια, φαινεται ομως σαν να εχει γινει μονο η αντιδραση με το ισχυρό, αφου καμια χρονικη στιγμη δεν μπορει να περισσεψει ισχυρο οξυ (ισχυει το «ισα αλλα οχι ιδια» οπως αναφερθηκε πιο πανω). Εγω εβλεπα το «πρωτα» απο την πλευρα της κινητικης (στιγμιαια, πριν την αποκατασταση της ισορροπιας). Γι’αυτο και επεμενα στην εκφραση «αντιδρα πληρως» και όχι «πρωτα».
Καταλαβα την παρανοηση οταν ειδα αυτή την ανάρτηση και θυμηθηκα τις καμπυλες των πολυπρωτικων οξεων. Ελεγα το ίδιο πράγμα με άλλα λογια… (και δεν ήταν και νυχτα!)
ΥΓ. Στο προηγούμενο σχολιο μου ξεφυγε ενα μηδενικο…
Διάλυμα 2ο: CCl2HCOOH 0,05 M – CH3COOH 0,10 M
1ο ΙΣ: VΙΣ = 5 ml , n1 = 5 ml*0,1 M = 0,5 mmol NaOH = 0,5 mmol CCl2HCOOH